细胞与基因治疗(CGT)已进入“技术迭代加速、临床转化提速”的黄金周期——据Grand View Research数据,2024年全球CGT市场规模已突破180亿美元,预计2030年将达862亿美元,年复合增长率超28%[1]。这一爆发式增长的背后,正是“精准融合”的技术协同(如mRNA+细胞治疗、基因编辑+AI)与“细胞赋能”的治疗革新(如CAR-T重塑肿瘤免疫、iPSC赋能异体治疗),而“下一代技术突破”与“临床转化落地”则成为行业从“小众”迈向“主流”的关键双轮。
01 前沿技术突破:
以“精准融合”重塑技术生态,以“细胞赋能”开拓治疗边界
当前CGT技术已从“单一创新”转向“系统协同”,通过整合多学科资源与先进技术平台,实现了研发、生产与临床应用的高效联动,推动了整个产业链的优化升级,为患者提供更精准、安全和可及的治疗方案。
mRNA技术与细胞治疗“精准融合”,靶向递送实现“细胞赋能”升级
mRNA技术的下一代突破,在于与细胞治疗的深度融合——通过精准递送使特定细胞的靶向性增强,而非单一的蛋白表达:
-
mRNA编辑DC细胞疫苗:Moderna与默克合作的mRNA-4157/V940,通过DC细胞的抗原呈递功能“赋能”抗肿瘤免疫,III期临床中黑色素瘤患者无复发生存期延长44%[2],这正是“精准融合”(mRNA+DC细胞)与“细胞赋能”(激活免疫细胞)的典型实践。在中国,近岸蛋白GMP级mRNA原料酶和细胞因子原料已助力客户靶向DC注射液完成中美IND申报。
-
tLNP-mRNA递送:Vertex研发的T细胞靶向LNP(CD47抗体修饰),可将mRNA精准递送至肿瘤浸润T细胞,通过表达IL-15“赋能”T细胞存活与增殖,在实体瘤小鼠模型中使T细胞浸润量提升8倍[3]。针对in vivo CAR新兴治疗方向,近岸蛋白提供in vivo CAR研发解决方案,覆盖CAR分子发现到靶向递送全流程,支持新一代细胞疗法。
基因编辑与AI“精准融合”,体内编辑实现“细胞赋能”的临床转化
基因编辑的下一代突破,聚焦“AI精准设计”与“体内细胞赋能”,解决临床转化中的脱靶与递送难题:
-
AI指导的精准基因编辑:Beam Therapeutics的BEAM-101(碱基编辑疗法),通过结构生物学手段优化编辑向导,实现对红细胞前体细胞的“功能赋能”(修复镰状细胞贫血基因突变),无需清髓预处理,I/II期临床治愈率达92%[4],推动体内编辑的临床转化;
-
体内细胞疗法:Intellia Therapeutics的NTLA-2002(第一个获批的体内基因编辑疗法),通过脂质纳米颗粒(LNP)将Cas9mRNA精准递送至肝脏细胞,敲除激肽释放酶B1(Kallikrein B1)基因,从而阻断血管水肿发作通路。在I/II期临床试验中,患者未接受清髓预处理,且数据显示长期随访下,平均每月发作率降低了98%[5]。近岸蛋白可提供GMP级AaCas12bMax等新型编辑蛋白(几乎不容忍任何单个碱基错配),支撑“体内基因编辑-细胞赋能”的临床转化需求;
-
新型基因编辑工具优势逐渐凸显:沙砾生物应用AaCas12bMax,开发基因敲除的下一代肿瘤浸润淋巴细胞(TIL)产品。今年5月,在ASCO年会上展示了3款TIL疗法的数据,包括GT101针对宫颈癌患者的初步疗效数据、新一代表达膜结合IL-15的GT201针对晚期实体瘤患者的临床疗效数据,以及CRISPR/Cas12b基因编辑的GT300针对冷肿瘤的早期临床数据。其中GT300是第一个应用于临床的CRISPR基因编辑型TIL疗法,5例妇科恶性肿瘤患者的ORR为60%,整体安全性良好[6]。
近岸蛋白新型的GMP级基因编辑蛋白AaCas12bMax,已完成FDA DMF备案,支持体内外基因编辑的临床转化需求。此外enCas12Ultra、enCas12hf的引入进一步丰富了自主知识产权的临床级基因编辑工具。相比传统Cas9系统,三款Cas12系列编辑器展现出同等的编辑活性和更低的脱靶效应,并已广泛应用于T细胞、iPSC等多种治疗性细胞,提高了基于基因编辑技术的CGT疗法的可及性,并加速商业转化进程。
细胞治疗:以“异体+多技术融合”,实现“细胞赋能”的规模化临床转化
细胞治疗的下一代核心,是通过“精准融合”(如基因编辑+异体CAR-T、iPSC)解决自体治疗的规模化难题,让“细胞赋能”惠及更多患者:
-
基因编辑+异体CAR-T:Allogene的Allo-501A(靶向CD19异体CAR-T),通过基因编辑敲除TCR与CD52基因,实现“精准去排异”。在I/II期临床试验中,针对复发/难治性大B细胞淋巴瘤患者,客观缓解率(ORR)高达75%,且展现出极高的安全性。更值得注意的是,其制备周期已从传统自体疗法的数周缩短至仅需3-5天,成本降低约60%[7]。通过“基因编辑+异体细胞”的精准融合,推动“细胞赋能”从“天价自体”走向“普惠异体”。近岸蛋白的多种GMP级细胞因子和抗体已成功支持异体细胞治疗的规模化培养;
-
iPSC+多类型细胞治疗:Fate Therapeutics的FT596(iPSC来源CAR-NK),通过iPSC的无限增殖特性“赋能”细胞治疗的工业化生产,无需依赖患者自体细胞。在I/II期临床试验中,针对复发/难治性B细胞淋巴瘤(R/R BCL)患者,客观缓解率(ORR)达到71%,其中完全缓解(CR)率约为50%[8]。近岸蛋白的GMP级TGF-β1等分化因子,支撑iPSC向NK细胞、心肌细胞等多类型细胞的精准分化,实现“iPSC-细胞治疗”的转化;
-
联合突破实体瘤:上海细胞治疗集团的BZD1901(自分泌纳米抗体CAR-T),通过“CAR-T+PD-1抗体”的精准融合,解除肿瘤微环境对T细胞的抑制,“赋能”CAR-T细胞浸润实体瘤,客观缓解率达63.6%[9]。
02 核心行业热点:
以“临床转化”为锚点,推动“精准融合”与“细胞赋能”落地
当前行业的关注重点,其实是要把“下一代新技术”真正用到病人身上,解决实际问题。而要实现这个目标,关键就在于两点:一是让治疗更精准地结合患者需求,二是提高疗法的可及性。
全球监管:为“精准融合”开辟临床转化通道
各国监管机构正针对“精准融合”类技术(如mRNA+细胞治疗、基因编辑+AI)优化审批路径:
-
FDA突破性疗法向融合技术倾斜:2024年,FDA加速批准了包括CRISPR基因编辑疗法在内的多项前沿细胞与基因治疗(CGT)创新成果[10]。以Vertex的Casgevy为代表,这些“下一代技术”凭借精准的分子设计与高效的递送系统,显著缩短了从临床到上市的研发周期,推动了治疗范式的快速迭代。
-
NMPA附条件批准聚焦“细胞赋能”疗效:根据中国国家药监局药品审评中心(CDE)发布的《细胞治疗产品临床药理学研究技术指导原则》及《药品附条件批准上市技术指导原则》,针对CAR-T、iPSC等高风险创新细胞治疗产品,若在中期临床试验中展现出明确疗效,可申请附条件批准上市。获批后,企业需通过上市后观察性研究或真实世界数据(RWE)进行长期随访与验证,以确证产品的有效性和安全性[11]。
-
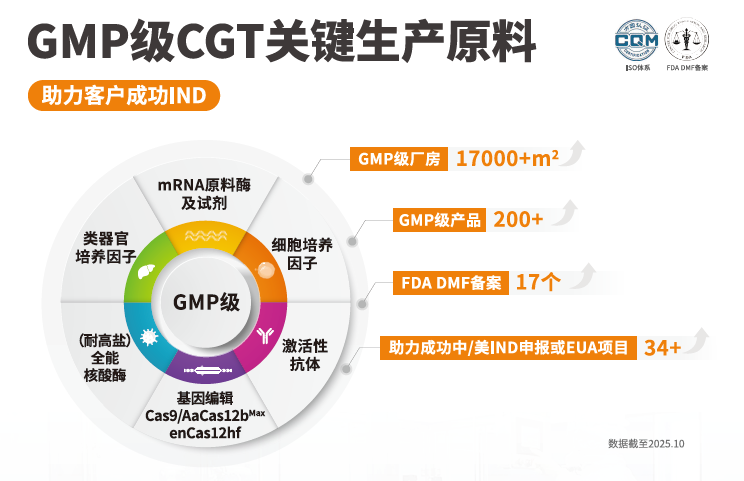
中美双报协同“精准融合”合规:随着全球监管科学的融合,FDA与NMPA正在探索针对mRNA疫苗、基因治疗等前沿领域的创新药研发同步申报(Parallel Submission)机制。近岸蛋白凭借其在关键原辅料领域的布局,17个产品已通过DMF(药物主文件)备案,为这类“精准融合技术”的全球临床转化提供了坚实的供应链支持。
商业化落地:以“精准融合”降本,以“细胞赋能”提升支付价值
CGT商业化的重点,是通过“精准融合”优化工艺,降低成本,通过“细胞赋能”提升疗效以匹配支付体系:
-
“细胞赋能”疗效支撑支付创新:中国多区域已将细胞疗法纳入惠民保,证明临床价值是支付体系接纳的关键。近岸蛋白通过规模化生产有效控制成本,助力“细胞赋能”疗法的支付可及性。
03 行业攻坚点:
聚焦“临床转化”痛点,破解“精准融合”与“细胞赋能” 瓶颈
当前行业的核心挑战,是“下一代技术”如何实现“临床转化”:
-
“精准融合”的技术协同难题:如mRNA与细胞治疗的融合中,靶向递送效率仍低、基因编辑与AI的融合中,脱靶检测缺乏临床标准,这些直接影响“细胞赋能”的治疗安全性;
-
“细胞赋能”的规模化瓶颈:异体CAR-T的细胞扩增稳定性不足、iPSC分化效率低,制约“下一代细胞治疗”的临床转化规模;
“临床转化”的合规壁垒:不同地区对“精准融合”技术的质控要求差异(如FDA要求mRNA-LNP的粒径偏差<10%,NMPA要求<5%)[12]、“细胞赋能”疗法的真实世界数据收集标准不统一,导致全球多中心临床推进缓慢。近岸蛋白也将结合自身合规与工艺经验,不断助力客户打破壁垒。
技术深耕:近岸蛋白的破局实践
多技术平台创新原料的“精准融合”,高效、稳定、合规,助力“细胞赋能”的临床转化
作为蝉联“CGT行业之星年度最优原材料提供商”的企业,为行业提供从“技术创新”到“临床转化”的全链条支撑。近岸蛋白提供一系列高效、稳定、合规的GMP产品,包括GMP级 Cas9/AaCas12bMax/enCas12hf/enCas12Ultra蛋白、
GMP级mRNA原料酶、GMP级全能核酸酶、GMP级细胞因子(如IL-2/IL-7/IL-15)、抗体和磁珠等。此外,近岸蛋白还提供多种类型的CAR-T阳性率检测试剂盒和靶点抗原,可用于CAR-T阳性率检测。
近岸之约
聚焦“精准融合”需求,深度对接“细胞赋能”资源
从mRNA与细胞治疗的融合突破,到基因编辑与AI的协同创新;从“天价疗法”到“普惠医疗”的商业化跨越,CGT行业的每一步前行,都离不开“精准融合”的技术协同与 “细胞赋能”的临床价值。2025年12月12-14日,上海汽车城瑞立酒店,2025年国际精准医疗与细胞基因治疗大会将成为“下一代技术”与“临床转化”的对接枢纽——在这里,您能听到行业领军者对“精准融合”的前沿判断,能获取“细胞赋能”疗法的临床转化方案,更能与近岸蛋白这样的产业链伙伴深度合作,解决从原料到工艺、从合规到商业化的全流程难题:
-
应对“合规性”要求:我们提供200+GMP级原料及17项FDA DMF备案,为您提供符合国际标准的申报资料,直接助力您的药品中美双报。
-
解决“供应链安全”焦虑:我们位于上海与菏泽的17,000+m²GMP级工厂,是实现核心原料本土化、规模化、稳定供应的坚实保障。
-
回应“降本增效”痛点:从基因编辑工具酶、GMP级细胞因子到mRNA原料酶,我们全流程的高品质、高性价比原料,旨在帮助您优化工艺,提高效率。
参展信息
展会名称|2025年国际精准医疗与细胞基因治疗大会
展会时间|2025年12月12-14日
展会地点|上海汽车城瑞立酒店
近岸蛋白展位号|B-16
精准融合,让技术突破更高效;
细胞赋能,让临床治疗更普惠;
2025年12月,上海,近岸蛋白与你并肩,
共探CGT临床转化的新未来!
参考文献
[1]Grand View Research. (2024). *Gene Therapy Market Size Worth $18.2 Billion by 2030*.
[2]Moderna, Inc., & Merck. (2024). Moderna and Merck Announce 3-Year Data For mRNA-4157 (V940) in Combination With KEYTRUDA(R) (pembrolizumab) Demonstrated Sustained Improvement in Recurrence-Free Survival & Distant Metastasis-Free Survival Versus KEYTRUDA in Patients With High-Risk Stage III/IV Melanoma Following Complete Resection.
[3]Papp, T. E., Zeng, J., Shahnawaz, H., Akyianu, A., Breda, L., Yadegari, A., ... & Parhiz, H. (2025). CD47 peptide-cloaked lipid nanoparticles promote cell-specific mRNA delivery. Molecular Therapy, S1525-0016(25)00192-3.
[4]Beam Therapeutics. (2024, November 6). Beam Therapeutics Announces Positive Clinical Data for BEAM-101 in Sickle Cell Disease. News Release.
[5]Longhurst, H. J., Gurugama, P., Boiselle, C., Shea, S., Picornell, C., Abdelhady, A., ... & Cohn, D. M. (2024). Transient exposure to NTLA-2002, an investigational CRISPR/Cas9-based gene editing therapy, leads to durable pharmacodynamic responses and attack control in patients with hereditary angioedema. New England Journal of Medicine, 390(1), 1-13.
[6]沙砾生物官方微信公众号;
[7]Locke, F. L., et al. (2023).Durable responses achieved with anti-CD19 allogeneic CAR T ALLO-501/501A in phase 1 trials of autologous CAR T-naïve patients with relapsed/refractory large B-cell lymphoma (r/r LBCL).Blood, 132(Supplement 1), 34-36.
Locke, F. L., Ghobadi, A., de Vos, S., Neelapu, S. S., Lin, T. K., Lekakis, L. J., ... & Miklos, D. B. (2021). Phase 1 trial results of the investigational off-the-shelf iPSC-derived CAR-NK cell therapy FT596 in patients with relapsed/refractory B-cell lymphoma. Blood, 138(Supplement 1), 34-36.
[8]《自分泌PD1纳米抗体靶向间皮素CAR-T细胞注射液(BZD1901)的临床研究》;
[9]PharmaBoardroom. (2025). FDA Cell & Gene Therapy Approvals 2024.
[10]《细胞治疗产品研究与评价技术指导原则(试行)》,2023.12.22,国家食药监总局。
[11]FDA Approvals 2024: PharmaBoardroom. (2025). FDA Cell & Gene Therapy Approvals 2024.
[12]NMPA Guidelines: ByDrug. (2024). NMPA发文:mRNA疫苗质量控制研究进展. Retrieved from pharmcube.com.
